-

タンパク質中で色が変わる色素の水素原子の可視化に世界で初めて成功
中性子構造解析と量子化学計算を組み合わせ 色素の緑と青の違いが生じる原因を解明
本学医学部医化学講座の久留米大学の杉島正一准教授、茨城大学の海野昌喜教授・城塚達也助教・日下勝弘教授・森聖治教授・矢野直峰助教、宮崎大学の和田啓准教授、久留米工業高等専門学校の萩原義徳准教授、ドイツのTechnical University Munich等との共同研究により、光合成色素のもとになる色素がタンパク質と結合したときにあらわれる色の違い(つまり吸収する光のエネルギー帯の違い)が、水素原子1つの違いによるものであることを世界で初めて可視化しました。
光合成生物シアノバクテリア中の色素の1つフィコシアノビリンは、ビリベルジンという色素が還元されて作られます。この還元に関わる酵素のアミノ酸1つを別のアミノ酸に置換すると、フィコシアノビリンを作らなくなることがあります。その不活性型の酵素のうち2種類については、同じ色素であるビリベルジンを結合したときに、活性を持つ野生型の場合と異なる色を示す(異なるエネルギーをもつ光を吸収する)ことは分かっていましたが、その詳しい原因はこれまで解明されていませんでした。
本研究グループは、茨城県東海村の大強度陽子加速器施設J-PARCやドイツ・ミュンヘンの研究用原子炉FRM IIという施設の中性子線を利用して、この2つの変異体酵素の構造を解析しました。その結果、結合したビリベルジンの水素原子の個数が1つだけ異なっていることを明らかにしました。また、この構造解析により、アミノ酸の置換(変異)が酵素を不活性にさせる理由も解明しました。さらに、量子化学計算により、ビリベルジンおよびそのまわりのアミノ酸の状態と色の違いとの関係を明らかにすることに成功しました。
この成果は、今後、広いエネルギー範囲の太陽光を効率よく吸収するための化合物の合成や、微妙な色の違いを出す染料などの合成に役立てられることが展望されます。
この成果は、12月1日にJournal of Biological Chemistryのオンライン版にてプレ公開、12月25日に本公開されました。
詳しくはプレスリリースをご覧ください。
背景
地球上で初めて酸素を発生する光合成をはじめた生物であるシアノバクテリアには、光合成に必要な太陽エネルギーを効率的に吸収するためのアンテナとなっているフィコビリソーム(図1)と呼ばれる巨大なタンパク質が存在しています。その中には、さまざまな種類の色素が含まれていて、その1つがフィコシアノビリンです。
フィコシアノビリンはPcyAという酵素(タンパク質の一種)によって、ビリベルジン(注1)という色素の2か所が還元されることで作られます。私達の研究グループでは、結晶構造解析という技術を中心に使って、PcyAや植物に存在するHY2というPcyAとよく似た酵素の立体構造や酵素反応の解析を行ってきました。その中で、PcyAのアミノ酸1つを別のアミノ酸に変換(変異)させると、ビリベルジン結合後の色が変化することを見出しました(図2)。この変異体酵素は、フィコシアノビリンを作ることができない不活性型でした。この色の違いについて、色素であるビリベルジンに結合している水素原子の状態に違いがあると予想していましたが、明確な証拠はありませんでした。
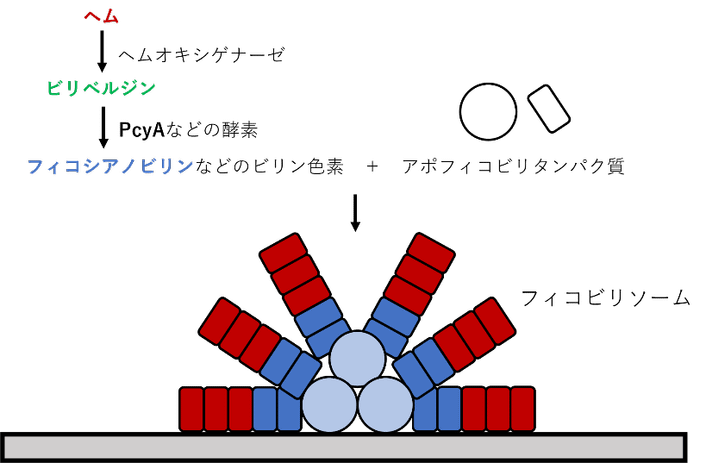
図1:フィコビリソームの模式図
ビリン色素がアポフィコビリタンパク質にくっつき、多数組み合わさることで、チラコイド膜の細胞質側に形成される。

図2:変異体酵素にビリベルジンが結合したときの色(どちらもpH 7、タンパク質以外の溶液組成は同じ)
タンパク質の立体構造について、原子が見える解像度で解析する手法としてX線結晶構造解析やクライオ電子顕微鏡法が一般的に使われていますが、これらは原子の中で一番小さな水素原子を見るのにはあまり適していません。そこで本研究では、タンパク質中の水素原子を明確に見ることができる中性子を利用し(茨城県東海村にある大強度陽子加速器施設(J-PARC)やドイツ・ミュンヘンにある研究用原子炉FRM IIを利用)、2つの不活性型変異体酵素の水素原子を含む構造解析に成功しました。その結果、色素(ビリベルジン)についた水素原子の数が1つ異なっていることがはっきりと可視化されました(図3)。
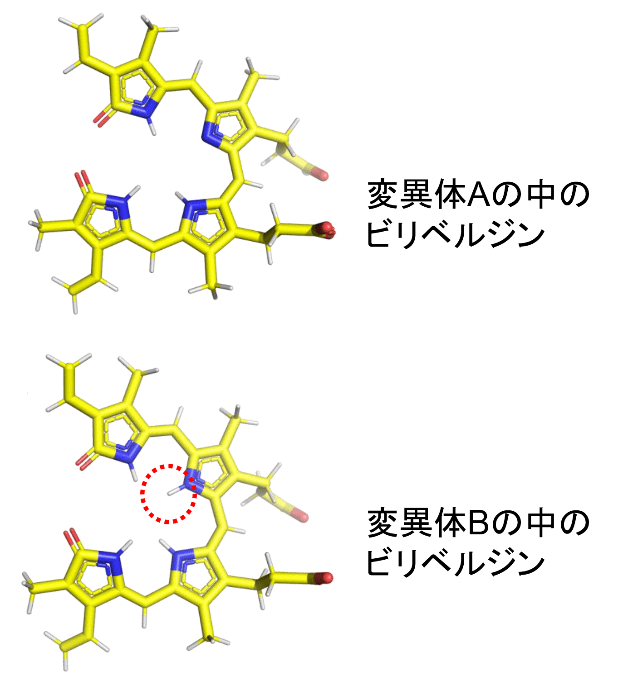
図3:変異体に結合した色素(ビリベルジン)の構造
黄色、青、赤、白はそれぞれ炭素(C)、窒素(N)、酸素(O)、水素(H)原子を示す。変異体Aの中のビリベルジン(上)には変異体Bの中のビリベルジン(下)で見られた水素原子が視られない。
私達の以前の中性子を用いた研究結果から、天然型のPcyAについたビリベルジンでは水素原子の結合数が異なる両方の状態が混ざっていることが分かっていましたが、変異体酵素ではどちらか片方だけの状態となっていました。
実験だけでは水素原子を含めた立体構造と色の関係を説明するのは難しいですが、京都大学や九州大学のスーパーコンピューターを用いた量子化学計算を組み合わせることで、ビリベルジンとその周辺のアミノ酸の水素原子の結合状態が色の違いを左右していることも分かりました。
ビリベルジンやフィコシアノビリンなどのビリン色素は、植物の中で赤色センサーとして働くタンパク質(フィトクロム)に結合した状態で、大きく構造変化(光異性化)をすることで色が変化することがよく知られていますが、今回の結果は、それとは異なり、ビリン色素の構造が大きく変わらなくても色の違いがあらわれることを明らかにしたものです。
その他に、PcyAがフィコシアノビリンを作るために必要な水素イオン(“プロトン”ともいう)をビリベルジンに運ぶためのアミノ酸の向きが変わっていることやその理由、それらの変化に関連した水分子の挙動変化もはっきりと分かりました。これらの変化で変異体酵素が不活性型となったことが推定できます。
今後の展望
今回の研究によって、PcyAによるフィコシアノビリン合成の最初の段階のメカニズムはかなり分かってきました。しかし、この反応は多くの段階を踏むと考えられており、後半の仕組みは良くわかっていません。これを明らかにするには、反応途中の構造の水素原子の可視化を行う必要があります。
また、色素がタンパク質に結合したときに、水素原子1つの違いで色が変わるということが一般的なのかを確かめるためには、その他の複数の色素とタンパク質が結合した状態の構造を、水素原子が視える解像度で明らかにしていくことが必要だろうと考えています。
こうした研究によって光合成色素が作られる仕組みを詳細に明らかにすることで、光を吸収して信号やエネルギーを伝達するような色素を効率良く生産することに応用できる可能性があります。また、吸収する光のエネルギー帯をコントロールする方法や、狙ったエネルギー領域の光を吸収する新しい色素の開発を進めることができるかもしれません。それらの色素が大量に安価に入手できれば、人工光合成のようなシステムに組み込むことにも夢が広がります。
注1)ビリベルジン:私達ヒトの血液にも存在するヘムから作られる色素。ヒトではビリベルジンの別の場所が還元されてビリルビン(胆汁色素)が作られる。
論文情報
論文タイトル:Neutron crystallography and quantum chemical analysis of bilin reductase PcyA mutants reveal substrate and catalytic residue protonation states
雑誌名:Journal of Biological Chemistry
著者名:Tatsuya Joutsuka*; Ryota Nanasawa; Keisuke Igarashi; Kazuki Horie; Masakazu Sugishima; Yoshinori Hagiwara; Kei Wada; Keiichi Fukuyama; Naomine Yano; Seiji Mori; Andreas Ostermann; Katsuhiro Kusaka; Masaki Unno* *Corresponding authors
公開日:プレ公開 2022年12月1日
お知らせ